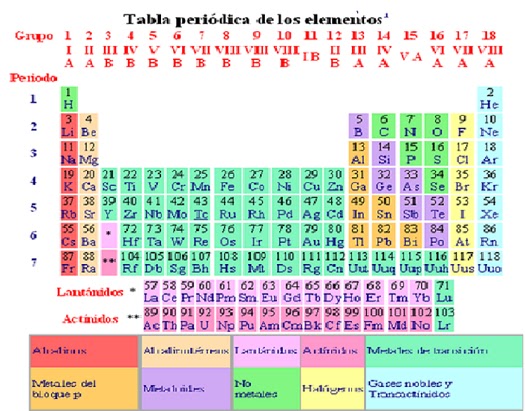
Es un esquema de
todos los elementos químicos dispuestos por orden de número atómico creciente
Están Ordenados en siete hileras horizontales
llamadas periodos y 18 columnas verticales, llamadas grupos
Su base es La ley periódica: “Las propiedades físicas y
químicas de los elementos tienden a repetirse de forma sistemática conforme
aumenta el número atómico”.
DESARROLLO HISTORICO
Desarrollo
Histórico 1829 Johann wolfgang Döbereiner clasificó los elementos según sus
propiedades semejantes en triadas.(grupo de 3 elementos) 1864
John Newlands clasificó los elementos por orden de masas atómicas crecientes en
octavas (grupo de 8 elementos).
1869 el ruso
Dimitry Mendeléiev y 1870 el alemán Lothar Meyer clasifican los elementos en
función periódica de sus masas atómicas (hoy en día realizada en función de su
número atómica).
Pueden
ampliar en este enlace.es.wikipedia.org/wiki/Tabla_periódica_de_los_elementos
Se encuentra
dividida en:
GRUPOS O FAMILIAS
Son Columnas verticales, con numeración romana
y designada con las letras A y B, también se utiliza numeración arábiga del 1
al 18. En los elementos representativos el número del grupo identifica los
electrones de valencia es decir los que se encuentran en el último nivel de
energía.
Los grupos
también se conocen con nombres de familias, por ejemplo:
Los grupos IA al
VIIA se conocen como elementos representativos
Los grupos B
junto con las series Lantánidas y Actinidas se conocen como elementos de
transición
PERIODOS
Son Columnas horizontales, con numeración arábiga
del 1 al 7 e identifican los niveles de energía que presenta el átomo.
NOTA: todos los elementos del grupo IA
tienen orbitales externos representados por ns1, donde n es el número cuántico principal de la
capa externa. Los elementos del grupo VIIA tienen orbitales externos designados
por ns2, np5, lo que significa que poseen siete
electrones en el último nivel de energía.
La tabla periódica
también puede dividirse en bloques o regiones, según la letra que hace
referencia al orbital más externo: bloque s, bloque p, bloque d y bloque f.
PROPIEDADES PERIODICAS
Son características que Presentan los
elementos químicos según su localización en el sistema periódico.
Las más importantes son
POTENCIAL DE IONIZACIÓN (P.I)
Es la Energía necesaria para remover
un electrón de un átomo gaseoso neutro y formar un ión positivo.
En la Tabla periódica el P.I. aumenta
en los periodos de izquierda a derecha y disminuye en los grupos de arriba
hacia abajo
Está relacionado con el radio atómico
de los átomos neutros